Sociedade de Pediatria de São Paulo
Texto divulgado em 28/12/2021
Introdução:
Um dos aspectos mais intrigantes da pandemia causada pela COVID-19, presente em todo o mundo, consiste no fato de que as crianças e adolescentes apresentam em sua maioria formas clínicas leves ou assintomáticas, com menor risco de complicações, hospitalizações e óbitos quando comparado com os adultos, em particular com os acima de 50 anos de idade [1].
Várias hipóteses foram formuladas para tentar explicar esse fenômeno (expressão da enzima conversora de angiotensina tipo 2 (ECA-2), que funciona como receptor da entrada do vírus, exposição recente a outros coronavírus – proteção cruzada, peculiaridades da qualidade da resposta imune, entre outros), porém as suas razões ainda são incertas [1].
Os estudos de soroprevalência populacionais por grupo etário realizados recentemente demonstram que as taxas encontradas em crianças de 5 a 11 anos são similares às dos adolescentes e superiores às taxas de soroprevalência em adultos. Este achado confirma as evidências epidemiológicas que apontavam que crianças e adolescentes são expostos ao vírus da mesma forma que adultos [2]. O papel das crianças na transmissão também já foi demonstrado em diversos estudos, particularmente das crianças maiores, sendo hoje reconhecidas como possíveis vetores de transmissão, mesmo que eventualmente com menor relevância que adultos [3].
Carga da COVID-19 em crianças e adolescentes no Brasil:
Até o início de dezembro de 2021 foram confirmados no Brasil aproximadamente 22 milhões de casos, 2 milhões e duzentas mil hospitalizações e 617 mil óbitos por COVID-19 [4].
Entre as hospitalizações por COVID-19, aproximadamente 34 mil foram notificadas entre crianças e adolescentes menores de 19 anos de idade. Entretanto, o dado que mais chama a atenção e preocupa é que houve a confirmação de mais de 2.500 mortes atribuídas à COVID-19 neste grupo etário. Crianças acima de 5 anos e adolescentes representaram aproximadamente 50% destas mortes. Entre as crianças e adolescentes hospitalizados por Síndrome Respiratória Aguda Grave (SRAG) por COVID-19 no Brasil, a taxa de letalidade foi de 7% [4].
Para se ter uma compreensão da importância destes achados, nos Estados Unidos (EUA), entre março de 2020 e maio de 2021, a COVID-NET identificou 3.106 crianças e adolescentes de 0 a 17 anos hospitalizados com infecção pelo SARS-CoV-2. Aproximadamente 30% das crianças internadas apresentaram COVID-19 grave e a taxa de letalidade entre as crianças internadas foi de apenas 0,5% [5].
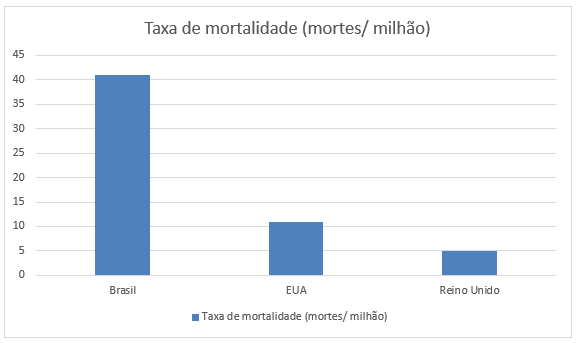
Uma análise das taxas de mortalidade (mortes por milhão) atribuídas à COVID-19 até novembro de 2021, mostra taxas de aproximadamente 41 mortes por milhão entre crianças e adolescentes no Brasil. Quando comparamos com outros países, em período similar, encontramos taxas de 11 mortes por milhão nos EUA [6] e 4,5 mortes por milhão no Reino Unido (RU) [7], mais uma vez destacando uma carga de doença com maior gravidade neste grupo etário no nosso país. Figura 1.
Figura 1: Taxas de mortalidade em crianças e adolescentes menores de 19 anos, associadas à COVID-19 no Brasil, EUA e RU.
Como exercício de comparação com outras doenças associadas a mortes em crianças, calculamos as mortes causadas por algumas das doenças passíveis de prevenção por vacinas no Brasil (doença meningocócica, Gastroenterite por rotavírus, Influenza no ano da pandemia por H1N1, hepatite A, varicela, meningite pneumocócica), nos anos que precederam a introdução das vacinas contra estas doenças no Programa Nacional de Imunizações (PNI). Nenhuma destas doenças provocou número igual de mortes que a COVID-19 em menores de 19 anos ao longo de 1 ano [8].
Além da SRAG causada pela COVID-19, foram notificados até o dia 27 de novembro de 2021, 2.435 casos suspeitos da Síndrome Inflamatória Multissistêmica Pediátrica (SIM-P), uma outra apresentação clínica potencialmente grave da doença, descrita em crianças e adolescentes. Deste total de casos notificados, 1.412 (58%) foram confirmados, resultando em 85 óbitos. As informações contidas no formulário de notificação publicado no Boletim Epidemiológico do Ministério da Saúde demonstram que, além da febre, os sintomas mais comumente relatados nas crianças com SIM-P foram os gastrointestinais (dor abdominal, diarreia, náuseas ou vômitos), presentes em cerca de 83,5% (n = 1.091) dos casos, rash cutâneo em 55,0% (n = 719) dos pacientes, conjuntivite em 39,5% (n = 516), alterações cardíacas em 59,2% (n = 774), hipotensão arterial ou choque em 35,5% (n = 464) e alterações neurológicas como cefaleia, irritabilidade, confusão mental ou convulsão em 48,0% (n = 628) das crianças acometidas. Cerca de 65,0% (n = 849) das crianças apresentaram sintomas respiratórios, incluindo coriza, odinofagia, tosse, dispneia ou queda da saturação [9].
Aqui, mais uma vez se faz importante destacar o fato de que no Brasil, a experiência com os casos de SIM-P mostrou um risco de morte muito superior ao observado em outros países. Entre as crianças hospitalizadas por SIM-P, a necessidade de internação em UTI ocorreu em 44,5% dos casos e a letalidade foi de 6% (cerca de 5 vezes superior à relatada nos Estados Unidos). Entre os sobreviventes, sequelas cardiovasculares, respiratórias e neurológicas foram descritas. Em publicação realizada pelo grupo do Ministério da Saúde em parceria com especialistas observamos que 64% das crianças/adolescentes hospitalizados pela SIM-P no Brasil tinham entre 1 e 9 anos de idade (mediana de idade: 5 anos) [10].
Um outro aspecto das consequências da COVID-19 é a chamada COVID longa, ou seja, a persistência de sintomas com impacto nos sistemas sensorial, neurológico e cardiorrespiratório, bem como a saúde mental, associados à doença meses após a infecção ter ocorrido. Os resultados dos estudos de seguimento de crianças e adolescentes acometidos pela COVID-19 ainda estão em curso, para fornecer evidências mais robustas do real impacto da COVID longa no grupo pediátrico, mas evidentemente é mais uma das faces da doença que deve ser considerada nas análises de riscos associados à infecção pelo SARS-CoV-2 em crianças.
Evidências de segurança, imunogenicidade, eficácia e efetividade da vacina BNT162b2 (Pfizer) em crianças e adolescentes:
As crianças e os adolescentes, em função do menor risco de complicações graves da COVID-19, foram definidos como não prioritários na ordem de disponibilização de doses nos programas de imunização em todo o mundo. Entretanto, nos locais onde os grupos prioritários já foram contemplados com a imunização, a progressão da vacinação para os adolescentes passa a ser um caminho natural e desejável. Na hierarquia de priorização, decidiu-se vacinar inicialmente crianças e adolescentes portadores de comorbidades e a seguir estender a vacinação às crianças e adolescentes saudáveis.
Adolescentes de 12-17 anos:
Neste momento, apenas o grupo de adolescentes com pelo menos 12 anos de idade está contemplado no programa de imunização contra a COVID-19 no Brasil, sendo a vacina de RNAm da Pfizer/BionTech (BNT162b2), a única autorizada para uso neste grupo etário (12 a 17 anos). Além de prevenir a ocorrência de casos, hospitalizações e mortes, existe uma perspectiva de a vacinação reduzir a chance da ocorrência de sequelas da doença em todas as suas formas, incluindo os casos de SIM-P, da COVID-19 longa, e ainda representar um mecanismo de segurança para o retorno das crianças e adolescentes ao convívio escolar.
A autorização de uso da vacina Pfizer em adolescentes foi baseada em estudo de fase 3, que incluiu 2.126 participantes de 12 a 15 anos. A maioria dos participantes era branca (85%), 90% dos adolescentes eram naive para o SARS-CoV-2 e imunocomprometidos não foram incluídos. Os participantes foram randomizados em uma razão de 1:1 para receber duas doses da vacina com 30μg ou placebo, com 21 dias de intervalo. Na análise de imunogenicidade, a razão da média geométrica de anticorpos neutralizantes após a dose 2 em participantes de 12 a 15 anos em relação aos participantes de 16 a 25 anos foi de 1,76 (intervalo de confiança de 95% [IC], 1,47 a 2,10), cumprindo o critério de não inferioridade (limite inferior do intervalo de confiança de 95% superior a 0,67). Foi ainda possível uma análise de eficácia, com observação de 16 casos, pelo menos 7 dias após a segunda dose da vacinação, todos eles observados no grupo que recebeu placebo [11].
Em relação à segurança, foi verificado após a implementação da vacinação de adolescentes em diversos países que existe um risco raro da ocorrência de miocardite/pericardite após as vacinas de RNAm, tanto com a Pfizer/BioNTech como com a Moderna, mais comumente após a segunda dose destas vacinas, dentro dos primeiros dias após a vacinação e com maior risco em pessoas do sexo masculino [12].
Este achado motivou uma análise conduzida pela ACIP (Advisory Committee on Immunization Practices), órgão responsável pelas recomendações de vacinação nos EUA, comparando os riscos e os benefícios oferecidos pela imunização com as vacinas de RNAm (Pfizer e Moderna) no contexto epidemiológico americano. A conclusão da ACIP foi que os benefícios da vacinação (prevenção de casos, hospitalizações e mortes) deste grupo etário superavam os riscos (ocorrência de casos de miocardite) em todos os grupos etários em que a vacinação está recomendada, tanto em adolescentes como em adultos jovens. Importante se faz destacar que os casos de miocardite/pericardite observados por efeito adverso da vacina de RNAm para COVID-19 têm sido quase sempre muito menos graves do que a miocardite na mesma faixa etária causada pela própria COVID-19 e do que miocardites observadas após outras causas, necessitando menos dias de internação (em média 3 dias) e menor necessidade de admissão em unidades de terapia intensiva [13].
Em estudo realizado no Canadá, um dos interessantes achados foi a constatação da influência do intervalo entre as doses da vacina no risco da ocorrência da miocardite/pericardite: intervalos entre as duas doses da vacina BNT162b2 (Pfizer), de até 30 dias, mostraram uma razão de risco 5,5 vezes maior (IC95%: 3,1-9,6) para a ocorrência de miocardite que quando o intervalo era de pelo menos 56 dias [14]. Este achado, junto com a consistente melhora da resposta imune quando intervalos maiores do que 30 dias são utilizados com esta vacina, sustentam a recomendação da implementação de programas de vacinação com pelo 8 semanas de intervalo entre as duas doses da imunização primária.
Após a introdução da imunização de adolescentes com a vacina BNT162b2 (Pfizer), diversos estudos de efetividade foram já publicados, com dados de mundo real da experiência de uso da vacina nos Estados Unidos, Israel e Reino Unido.
Estudo de coorte retrospectiva, realizado em Israel, estimou a efetividade da vacina contra infecções por SARS-CoV-2 confirmadas laboratorialmente por PCR, entre adolescentes de 12 a 15 anos vacinados com duas doses separadas por 21 dias. Os resultados foram consistentes, com demonstração de efetividade da vacina BNT162B2, 8-28 dias após a segunda dose, de 91,5% (IC 88,2%-93,9%). No período de seguimento do estudo nenhum dos adolescentes vacinados que se tornaram SARS-CoV-2-positivos nos dias 1 a 28 após a segunda dose da vacina foram hospitalizados [15].
Nos EUA, após a recomendação de vacinação de adolescentes, estudo caso-controle conduzido em 16 estados entre 1º de junho e 30 de setembro de 2021, a efetividade de duas doses da vacina Pfizer-BioNTech contra a hospitalização por COVID-19 foi avaliada entre crianças e adolescentes de 12 a 18 anos. A exemplo do que havia sido observado em Israel, a efetividade de 2 doses da vacina Pfizer-BioNTech contra hospitalização por COVID-19 foi robusta, de 93% (IC95% = 83%-97%), em um período em que a variante Delta era protagonista das infecções nos EUA. Todos os 77 adolescentes internados em unidades de terapia intensiva, todos os 29 adolescentes que foram considerados como tendo COVID-19 grave, e os dois óbitos registrados, ocorreram entre adolescentes não vacinados [16].
Crianças de 5 a 11 anos:
Os estudos em crianças menores de 12 anos com a vacina de RNAm da Pfizer tiveram inicialmente, na fase 1, a definição de concentração da dose a ser utilizada. Para as crianças de 5-11 anos a dose escolhida para ser testada foi a de 10 microgramas (1/3 da dose usada nos adolescentes e adultos) e para as crianças menores de 5 anos a dose escolhida foi a de 3 microgramas (1/10 da dose dos adultos e adolescentes).
Nos estudos de fase 2/3, uma vez definida a dose, os objetivos primários foram de avaliar segurança, tolerabilidade e imunogenicidade (resposta de anticorpos – por método de immunobridging – ou seja, de demonstração de não inferioridade da resposta de anticorpos neutralizantes sete dias após a segunda dose em relação ao grupo comparador, de 16-25 anos, onde houve demonstração de eficácia). Como objetivos secundários, entre outros, foi estabelecida a investigação de eficácia para prevenção de doença. Além disso estão também avaliando eficácia contra infecção assintomática.
Neste estudo de fase 2/3, os participantes foram aleatoriamente randomizados em uma razão de 2:1 para receber duas doses da vacina BNT162b2 na dosagem identificada durante o estudo de fase 1 ou placebo. As respostas imunes um mês após a segunda dose da vacina BNT162b2 foram comparadas com as respostas observadas em adolescentes e adultos de 16 a 25 anos do ensaio pivotal com duas doses de 30μg de BNT162b2. A eficácia da vacina contra Covid-19, sete dias ou mais após a segunda dose foi também avaliada. [17]
No estudo, que incluiu 2.268 participantes de 5 a < 12 anos de idade, após duas doses da vacina BNT162b2 em uma apresentação com 10µg (1/3 da apresentação utilizada em adolescentes e adultos) as crianças apresentaram uma resposta de anticorpos neutralizantes em concentrações similares às observadas em adolescentes e adultos de 16-25 anos. Um mês após a segunda dose, a razão média geométrica de anticorpos neutralizantes em crianças de 5 a 11 anos sobre aqueles de 16 a 25 anos de idade foi de 1,04 (95% de confiança no intervalo [IC], 0,93 a 1,18), atendendo o critério de não inferioridade [17].
Além disso, houve demonstração de eficácia de 90.7% (IC95%, 67,7 a 98,3%) para a prevenção da COVID-19 pelo menos sete dias após a segunda dose e em um período de aproximadamente 2-3 meses. Não foram observados, nestes estudos, eventos adversos graves associados à vacinação, com um perfil de reatogenicidade favorável. Os dados de farmacovigilância reportados nos EUA pelo sistema de vigilância de eventos adversos (VAERS) foram apresentados recentemente em uma reunião da ACIP: neste relatório, os dados disponibilizados apontam para a manutenção da avaliação favorável à vacinação dessas crianças [18].
Nos EUA, até 9 de dezembro de 2021, 7.141.428 doses da vacina pediátrica da Pfizer já foram administradas em crianças de 5 a 11 anos (5.126.642 destas como primeira dose e 2.014.786 como segunda dose). A vacina demonstrou um perfil de reatogenicidade adequado, sendo a quase totalidade dos eventos adversos classificados como não sérios (97%), caracterizados basicamente por febre, dor de cabeça, vômitos, fadiga e inapetência. As reações mais frequentemente relatadas foram leves a moderadas em gravidade. A maioria das vezes relatadas no dia seguinte à vacinação, ligeiramente mais frequente após a dose 2 e transitória na sua natureza. Houve o relato de apenas 8 casos de miocardite em mais de 7 milhões de doses administradas (2 casos após a primeira dose e 6 casos após a segunda dose), todos eles classificados como de evolução clínica favorável. Estes dados preliminares mostram, portanto, um risco menor deste evento adverso comparado com o risco previamente observado em adolescentes e adultos jovens após a vacinação [18].
Alguns países como a Argentina e o Chile já iniciaram a vacinação de crianças acima de 3 anos, com vacinas de vírus inteiros inativada, dos fabricantes chineses Sinopharm e Sinovac, respectivamente. Estas vacinas, levando em conta os seus perfis de segurança, parecem uma interessante opção para uso em crianças e adolescentes saudáveis.
Conclusão:
Conforme demonstrado, a despeito do menor risco de complicações da doença em crianças quando comparada aos adultos, a carga da COVID-19 em crianças no Brasil está longe de ser negligenciável, com taxas de letalidade e de mortalidade associadas à doença muito maiores que as registradas em outros países, merecendo um olhar diferenciado e cauteloso por parte das autoridades responsáveis pelas políticas de saúde pública no nosso País.
A menor gravidade da COVID-19 em crianças quando comparada com adultos fez com que, infelizmente, houvesse uma subestimação da sua real carga neste grupo etário. Os estudos com a vacina de RNAm (BNT162b2) da Pfizer demonstraram que a doença e suas complicações são passíveis de prevenção, inclusive em adolescentes e crianças. Aumentar o universo de vacinados oferece além da proteção direta da vacina, possibilidade de redução das taxas de transmissão do vírus e das oportunidades de surgimento de variantes. Os eventos adversos relatados, tanto nos estudos clínicos como nos dados de farmacovigilância de mundo real, ocorrem de forma rara e em frequência substancialmente menor que os benefícios da vacinação.
Os critérios para introdução de uma vacina em um programa de imunizações não se resumem à prevenção das mortes relacionadas à doença contra a qual se deseja uma intervenção. Conforme salientado no texto, influenza, diarreia por rotavírus, varicela, hepatite A, meningite meningocócica, entre outras doenças, faziam menos vítimas ao longo de um ano do que a COVID-19 em pediatria e não hesitamos em incorporar em programas de saúde pública vacinas para a prevenção destas doenças e de suas complicações. Vacina-se para prevenir hospitalizações, sequelas, uso de antibióticos, visitas aos serviços de saúde, ocupação de leitos em UTI, entre outros. A prevenção de mortes em crianças tem elevado valor quando comparada à prevenção da morte em um adulto. Além de tudo isso, o aspecto da proteção indireta, reduzindo casos secundários deve ser sempre considerado. Existem justificativas éticas, epidemiológicas, sanitárias e de saúde pública para a vacinação da população pediátrica.
A presença de uma variante como a Ômicron, com maior transmissibilidade, mesmo se comprovada sua menor severidade, torna grupos não vacinados (como crianças menores de 12 anos) mais vulneráveis ao risco da infecção e suas complicações, conforme vem sendo observado em outros países com presença desta variante. Neste contexto epidemiológico, estamos convencidos que ampliar o benefício da vacinação a este grupo etário é sim uma prioridade.
Departamento de Imunizações da Sociedade de Pediatria de São Paulo
Prof. Dr. Marco Aurélio Sáfadi
Dr. Renato de Ávila Kfouri
Referências:
1) Safadi MA. The intriguing features of COVID-19 in children and its impact on the pandemic, Jornal de Pediatria (2020), doi:https://doi.org/10.1016/j.jped.2020.04.001
2) ACIP meeting. November 2021. Epidemiology of COVID-19 in Children Aged 5 –11 years. Available at: chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/viewer.html?pdfurl=https%3A%2F%2Fwww.cdc.gov%2Fvaccines%2Facip%2Fmeetings%2Fdownloads%2Fslides-2021-11-2-3%2F03-COVID-Jefferson-508.pdf&clen=918269&chunk=true.
3) CDC Science Brief: Transmission of SARS-CoV-2 in K-12 schools. https://www.cdc.gov/coronavirus/2019-ncov/science/science-briefs/transmission_k_12_schools.html
4) Ministério da Saúde. Boletim epidemiológico. Doença pelo Novo Coronavírus – COVID-19. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/boletins/boletins-epidemiologicos-covid-19/2021/boletim_epidemiologico_covid_92_10dez21.pdf/view
5) Woodruff RC, Campbell AP, Taylor CA, et al.; COVID-NET surveillance team. Risk Factors for Severe COVID-19 in Children. Pediatrics. 2021 Oct 22:e2021053418. doi: 10.1542/peds.2021-053418
6) CDC. Demographic Trends of COVID-19 cases and deaths in the US reported to CDC. Disponível em: https://covid.cdc.gov/covid-data-tracker/#demographics.
7) UK. Deaths registered weekly in England and Wales, provisional. UK. https://www.ons.gov.uk/peoplepopulationandcommunity/birthsdeathsandmarriages/deaths/datasets/weeklyprov
isionalfiguresondeathsregisteredinenglandandwales
8) Brasil. Ministério da Saúde. CASOS CONFIRMADOS NOTIFICADOS NO SISTEMA DE INFORMAÇÃO DE AGRAVOS DE NOTIFICAÇÃO – BRASIL. Disponível em: http://tabnet.datasus.gov.br/
9) Ministério da Saúde. Boletim epidemiológico 91. Doença pelo Novo Coronavírus – COVID-19. Disponível em: https://www.gov.br/saude/pt-br/assuntos/boletins-epidemiologicos/numeros-recentes/numeros-recentes
10) RELVAS-BRANDT, L. DE A. et al. Síndrome inflamatória multissistêmica pediátrica: estudo seccional dos casos e fatores associados aos óbitos durante a pandemia de COVID-19 no Brasil, 2020. Epidemiologia e Serviços de Saúde, v. 30, n. 4, p. e2021267, 2021
11) Frenck RW Jr, Klein NP, Kitchin N, et al.; C4591001 Clinical Trial Group. Safety, Immunogenicity, and Efficacy of the BNT162b2 Covid-19 Vaccine in Adolescents. N Engl J Med. 2021 Jul 15;385(3):239-250. doi: 10.1056/NEJMoa2107456. Epub 2021 May 27. PMID: 34043894; PMCID: PMC8174030
12) Centers for Disease Control and Prevention. Clinical considerations; myocarditis and pericarditis after receipt of mRNA COVID-19 vaccines among adolescents and young adults. May 28, 2021. https://www.cdc.gov/vaccines/covid-19/clinical-considerations/myocarditis.html
13) Centers for Disease Control and Prevention (CDC). Advisory Committee on Immunization Practices (ACIP). Coronavirus disease 2019 (COVID-19) vaccines.Accessed July 6, 2021. https://www.cdc.gov/vaccines/acip/meetings/slides-2021-06.html
14) Buchan SA, Seo CY, Johnson C et al. Epidemiology of myocarditis and pericarditis following mRNA vaccines in Ontario, Canada: by vaccine product, schedule, and interval. doi: https://doi.org/10.1101/2021.12.02.21267156.
15) Glatman-Freedman A, Hershkovitz Y, Kaufman Z, et al. Effectiveness of BNT162b2 Vaccine in Adolescents during Outbreak of SARS-CoV-2 Delta Variant Infection, Israel, 2021. Emerg Infect Dis. 2021 Nov;27(11):2919-2922. doi: 10.3201/eid2711.211886.
16) Olson SM, Newhams MM, Halasa NB, Price AM, et al. Effectiveness of Pfizer-BioNTech mRNA Vaccination Against COVID-19 Hospitalization Among Persons Aged 12-18 Years – United States, June-September 2021. MMWR Morb Mortal Wkly Rep. 2021 Oct 22;70(42):1483-1488. doi: 10.15585/mmwr.mm7042e1
17) Walter E, Talaat KR, Sabharwal C et al. Evaluation of the BNT162b2 Covid-19 Vaccine in Children 5 to 11 Years of Age. NEJM 2021. DOI: 10.1056/NEJMoa2116298
18) CDC Awardee COVID-19 Vaccination Planning Meeting. Adverse events among children ages 5–11 years after COVID-19 vaccination: updates from v-safe and the Vaccine Adverse Event Reporting System (VAERS). Disponível em:
https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-12-16/05-COVID-Su-508.pdf
19) COVID in Children: “Striking Increase” – NY Urgent Advisory as Child COVID Hospitalizations Quadruple. Disponível em: https://www.nbcnewyork.com/news/coronavirus/striking-increase-ny-urgent-advisory-to-pediatricians-as-child-covid-hospitalizations-quadruple/3467510/




